Теория электролитической диссоциации
Второй основополагающей предпосылкой для современного объяснения механизма возникновения и проведения нервного возбуждения стала теория электролитической диссоциации шведского учёного Сванте Аррениуса (Arrhenius, Svante August, 1859–1927).
Теория Вант-Гоффа отлично подтверждалась для многих растворов, например, для сахарозы или для водного раствора CO2. Но для некоторых веществ осмотическое давление оказывалось вдвое больше расчётного. Погрешность составляла ровно 100%. Вряд ли её можно было объяснить неточностью измерений.
Обдумывая возможные причины этого расхождения, единомышленник Вант-Гоффа Аррениус догадался, что если, например, для поваренной соли давление оказывается вдвое больше расчётного, то значит, в растворе вдвое больше частиц, чем молекул NaCl, то е. молекула NaCl в воде распадается на две частицы: Na и Сl.
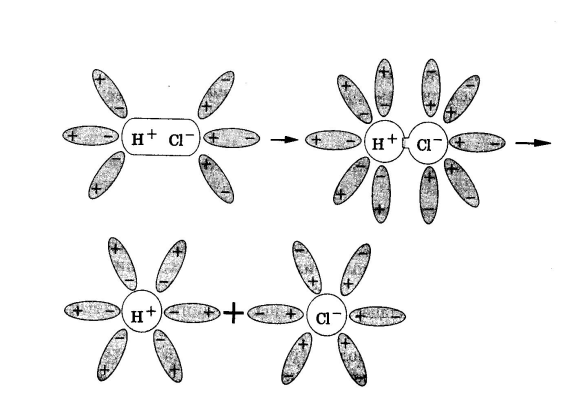 Таким образом, суть теории Аррениуса состоит в следующем: при растворении
молекул неорганических и органических кислот, гидроксидов и солей они
распадаются (дисоциируют) на ионы:
Таким образом, суть теории Аррениуса состоит в следующем: при растворении
молекул неорганических и органических кислот, гидроксидов и солей они
распадаются (дисоциируют) на ионы:
HСl на Н+ и Cl – ,
NaOH на Na+ и OH– ,
K2SO4 на 2K+ и SO4–.
Ионы представляют собой заряженные частицы, которые состоят из отдельных атомов, или из групп атомов. Именно эти ионы являются носителями электричества в жидкостях, в отличие от металлов, где перенос электричества осуществляют электроны.
Аррениус пришёл к идее электролитической диссоциации. Суть её в том, что частицы, на которые распадаются многие вещества в растворах, и есть те самые ионы – носители электрических зарядов, с помощью которых ещё Фарадей объяснял законы электролиза.
До Аррениуса учёные полагали, что ионы возникают под влиянием электрического тока, но исследования явления осмоса показало, что это не так. Уже в самом растворе даже в отсутствие электричества имеются и движутся заряженные атомы и молекулы.
На основе идеи электролитической диссоциации были даны первые научные определения понятием «кислота» и «основание», согласно которым кислота (например, HCl) это водородосодержащее соединение при диссоциации которого образуются ионы водорода, а основание – например, NaOH, соединение при диссоциации которого образуются ионы гидроксида.
Причины, приводящие к явлению диссоциации, в теории Аррениуса не рассматривались. Не обсуждался также вопрос о том, почему заряженные частицы, на которые должны были бы распространяться законы электростатики, не взаимодействуют друг с другом в растворе [40].
В 1903 году Сванте Аррениус за теорию электролитической диссоциации получил Нобелевскую премию в области химии.
Обычно в книгах по неврологии идёт отсылка к теории Аррениуса, а дальше описываются мембранные потенциалы, как само собой разумеющееся. Но для любопытного читателя замечу, что в теории электролитической диссоциации рассматриваются чисто электрохимические процессы в электролите. Она больше подходит к разборкам в споре между Луиджи Гальвани и Александром Вольта.
В 1890 году Вильгельм Оствальд (1853-1932), продолжая исследования полупроницаемых искусственных плёнок, совместил све́дения об осмосе с положениями теории диссоциации. Он обнаружил, что полупроницаемость плёнок может вызвать не только осмос, но и стать причиной электрических явлений.
Осмос возникает тогда, когда сквозь мембрану приникают относительно мелкие молекулы растворителя (например, воды), но не проходят крупные молекулы растворенного в ней вещества. Но ведь в электролите и ионы могут иметь разные размеры!
Если взять жидкость в сосуде разделить её полупроницаемой плёнкой на две части, в левую и правую части сосуда добавить электролит разной концентрации, и если сквозь плёнку могут проникать только относительно мелкие ионы, например, отрицательные, то после диффузии электролита между левой и правой половинами сосуда возникнет разность электрических потенциалов.
Оствальд также предположил, что свойствами полупроницаемой мембраны можно объяснить возникновение электрических потенциалов мышц, нервов, а также электрических органов рыб. Идея Оствальда, как ни странно, оказалась незамеченной ни биологами, ни физиологами того времени. И только Юлиус Бернштейн (J. Bernstein) спустя десять лет смог по достоинству её оценить.