Осмос
Началом этой истории послужило открытие осмоса. Думаю, что не все наши читатели слышали это слово раньше, так вот, осмос – это процесс, в котором при определённом давлении растворитель проходит через полупроницаемую мембрану из более концентрированного в менее концентрированный раствор. При этом мембрана пропускает растворитель, но не пропускает растворённые в нём вещества.
Впервые в 1748 году осмос наблюдал Жан-Антуан Нолле (Jean-Antoine Nollet, 1700–1770) – французский священник (аббат) и физик, член Парижской академии наук с 1739 года.
Легенда гласит, что однажды аббат Нолле слил недопитое им вино во фляжку из свиного мочевого пузыря и погрузил его охладить в бочку с водой. Наутро вынув пузырь из бочки, он обратил внимание, что тот раздулся. Попробовав вино, аббат понял, что напиток стал менее крепким. Нолле сделал вывод, что вино стало разбавленным из-за того, что вода проникла в него сквозь стенку сосуда под действием некой силы, которая возникла из-за разницы концентрации воды в бочке и в вине. При этом аббат заметил, что через стенку пузыря проникла только вода. Если ли бы пузырь с вином, который Нолле положил в воду, не обладал способностью растягиваться, проникающая вода подняла бы давление и процесс бы остановился. Давление, которое необходимо приложить, чтобы не пустить воду в вино называется осмотическим. Оно зависит от разности концентраций растворённых веществ по обе стороны мембраны.
Пример осмоса: к яичной скорлупе с внутренней стороны прилегает плёнка - это тоже полупроницаемая мембрана, она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10% соответственно, то через неё в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. При этом объёмы разделённых мембраной растворов изменятся. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие.
Однако целенаправленное исследование этого явления было начато лишь спустя столетие.
В середине XIX века осмотическую проницаемость клеточных мембран изучали физиолог Моль и ботаник Негели. А с конца XIX века к ним присоединились физики и химики, одним из которых был немецкий учёный Адольф Фик. В 1855 году исследуя перенос через искусственные мембраны из нитроцеллюлозы, он сформулировал феноменологические законы диффузии, названные впоследствии его именем.
Одним из выдающихся учёных, работавших в этой области, был Вильгельм Пфеффер (нем. Wilhelm Friedrich Philipp Pfeffer, 1845 – 1920) – немецкий ботаник и физиолог растений. Он изучал осмотические явления, обусловливающие поглощение растениями воды и минеральных веществ. Работы Пфеффера заложили основы мембранной теории клеточной проницаемости.
В 1877 году он изготовил искусственную полупроницаемую мембрану. Для этого в пористый фарфоровый сосуд он налил раствор медного купороса и поместил его в другой сосуд, заполненный раствором ферроцианида калия. В порах первого фарфорового сосуда растворы контактировали и взаимодействовали друг с другом. В результате в них образовывалась плёнка из ферроцианида меди, которая обладала полупроницаемостью.
Далее, полученный сосуд, в порах которого образовалась полупроницаемая мембрана, заполненный раствором сахарозы, помещали в воду.
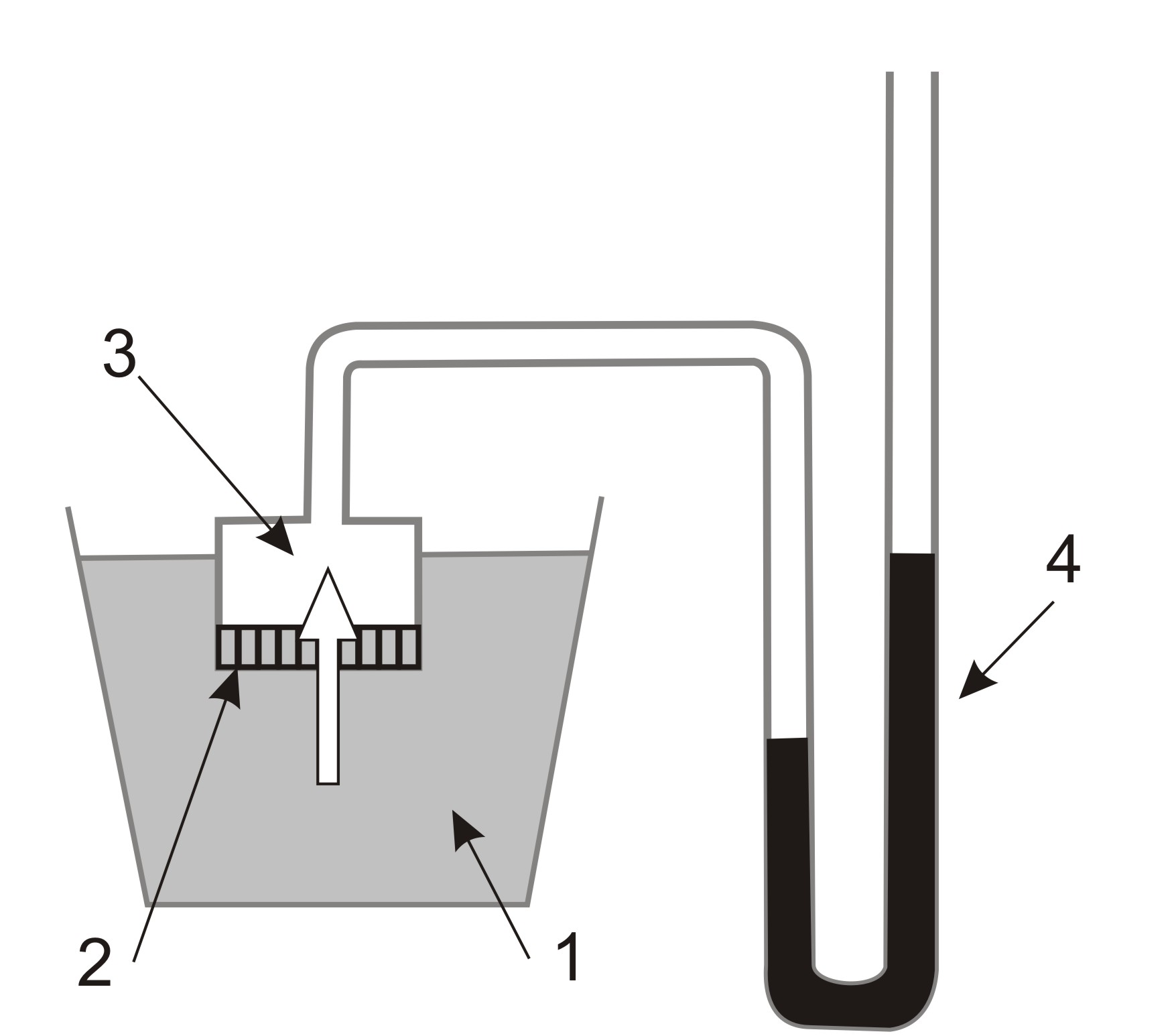
Такой прибор получил название осмометра. Схема осмометра Пфеффера на Рис.29: 1 – сосуд с растворителем; 2 – мембрана; 3 – ячейка с раствором; 4 – манометр.
В результате своих исследований, Пфеффер установил, что поступление воды в раствор через полупроницаемую перегородку обусловлено разностью концентраций растворов.
Однако Пфеффер не обнаружил какой-либо количественной зависимости осмотического давления от концентрации и температуры. Данную задачу спустя двадцать лет разрешил Вант-Гофф (Jacobus Henricus (Henry) van't Hoff; 1852 – 1911).
В 70-х годах 19 века молодой голландский ботаник X. Де Фриз исследовал влияние осмоса на изменение объёма клеток растений в растворах разной концентрации.
В 1894 году Де Фриз рассказал о работах Пфеффера молодому химику Я. Вант-Гоффу. Внимательно изучив исследования Пфеффера, Вант-Гофф обратил внимание, что осмотическое давление в разных растворах получается одинаковым, если измерять концентрацию не в граммах на литр, а в молях, т. е. существенной является не масса, а число молекул растворённого вещества. Допустив, что молекулы растворённого вещества ведут себя как молекулы идеального газа он решил, что для выражения осмотического давления можно использовать уравнение Менделеева-Клапейрона. [7]
За теорию растворов Вант-Гофф спустя 15 лет получил Нобелевскую премию по химии. Вот такой важный вклад в науку внёс Де Фриз, поговорив с Вант-Гоффом.
Осмос играет исключительно важную роль в живой природе. Это явление лежит в основе корневой системы питания растений. Благодаря осмосу влага в растениях поднимается и удерживается на высоте в десятки метров.
Питание представителей царства животных также происходит благодаря осмосу. Кровь и лимфа животных – это растворы органических и неорганических веществ. Если концентрация веществ в пищеварительном тракте ниже, чем в крови, влага с питательными веществами всасывается в кровь. Если же концентрация веществ в крови по каким-то причинам окажется ниже, чем в кишечнике (животное объелось соли), всасывание меняет направление, организм обезвоживается, животное погибает.
Осмос оказался причиной внутреннего давления в клетке, именно благодаря ему наши клетки выглядят округлыми и упругими.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с бо́льшим осмотическим давлением является гипертоническим, а с меньшим - гипотоническим. При нахождении клеток в изотоническом растворе они сохраняют свой размер и нормально функционируют.
Если же поместить клетки в гипотонический раствор, вода из менее концентрированного внешнего раствора станет переходить внутрь клеток, что приведёт к их набуханию, некоторое время клетка ещё может сохранять целостность, но если процесс не прекращается клеточная оболочка разорвётся и её содержимое вытечет наружу. Такое разрушение клеток называется лизисом.
При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор, и наблюдается сморщивание (обезвоживание) клеток. Это явление называется плазмолизом.
Живая клетка представляет собой осмотическую систему. Её мембрана хорошо проницаема как для воды, так и для растворённых питательных веществ.
Осмос, в свою очередь, это результат диффузии воды или другого растворителя через полупроницаемую перепонку, вызванной разностью концентраций или разностью химических потенциалов. Наблюдения за данными явлениями позволяют изучить многие свойства клетки.